ハナビラタケ安定栽培技術の開発
~子実体原基形成を誘導する光条件について~
林業研究所 井上 伸
◆はじめに
ハナビラタケは、ハナビラタケ科ハナビラタケ属のきのこで、初夏から秋にかけてマツなど針葉樹の根元や切り株に生え、その見た目から英名では、カリフラワーマッシュルームと呼ばれています(写真-1)。ハナビラタケは、独特な食感のあるおいしいきのこで、機能性成分であるβ-グルカン含有量が多いなどの特徴がありますが、その栽培の難しさから、国内生産量は少なく、安定生産技術の確立が課題となっています。

写真-1.野生のハナビラタケ
量販店等で販売されているきのこ類の多くは、菌床栽培(図-1)で生産されています。例えば、林野庁が行った特用林産物生産統計調査では、令和2年全国の生シイタケ生産量のうち、90%以上が菌床栽培であると報告されており、シイタケ栽培では、原木栽培はわずかで、菌床栽培が主流であることがうかがえます。当研究所で行っているハナビラタケに関する研究においても、菌床を用いた栽培試験を行っています。
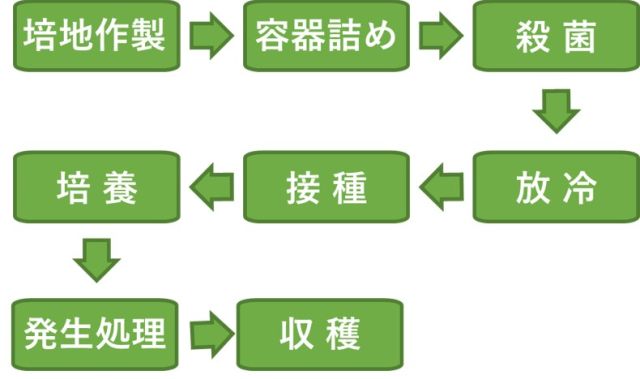
図-1.一般的な菌床栽培工程
一般的にきのこ類の子実体(普段、我々が食べる部分)のもとになる原基(きのこの芽)の形成は、温度や光などの刺激により誘導されます。エノキタケやシイタケなどの菌床栽培においても、上記のような刺激を人工的に与えることにより、安定的に栽培されていますが、きのこの種類によって、適した処理は異なります。ハナビラタケの原基形成については、当研究所の研究結果より、光による刺激が大きく影響することが分かっています。
そこで、本稿では、培養時の光条件の違いがハナビラタケの原基形成に与える影響に関して試験した結果について紹介します。なお、本研究は、令和2年度岡三加藤文化振興財団研究助成により行いました。
◆インキュベーターを用いた培養試験
培地材料には、基材にカラマツおが粉、栄養体にフスマ、菌糸活性剤にオルガK-1((株)かつらぎ産業)を用いました。これらを混合し、水を加え、含水率を65%程度に調整した後、200mlの三角フラスコに定量詰めし、殺菌放冷後、あらかじめ培養したハナビラタケ菌株を接種し、供試体としました。
培養には、インキュベーター(温度を一定に保つ機器)2台を用い、両方とも温度設定を22 ℃とし、一方は、器内にある蛍光灯を常時点灯した明環境、もう一方は、蛍光灯を点灯しない暗環境としました。
処理区は、①明環境にそのまま供試体を置く、明培養区、②供試体にアルミホイルを巻き、供試体内部に光が入らないようにした後、明環境に置く、遮光区、③暗環境に供試体を置く、暗培養区の3処理区を設定しました。各処理区とも供試体を5個設置し、接種から50日経過後と70日経過後に原基形成の有無(写真-2)を確認しました。

写真-2.培地上に形成された子実体原基
結果を表-1に示します。原基形成が確認されたのは、明培養区のみでしたが、明培養区においても原基を形成しない供試体が確認されました。遮光区では、50日経過時点で原基形成が確認されなかったことから、アルミホイルを外し、明環境下で接種後70日まで培養を行いましたが、原基は形成されませんでした。
表-1.光環境と子実体原基形成の関係

原基形成の有無は、〇:有、×:無とした。
また、原基形成率は、原基形成した供試体本数÷全供試体数で表す。
これらのことから、ハナビラタケの子実体原基形成を誘導するためには、光が必要な条件であることが考えられました。また、遮光区の結果より、光を用いて原基形成を誘導するためには、適した時期に光を照射する必要がある可能性が示唆されました。
◆菌床培養施設を用いた培養試験
培地材料には、基材にカラマツおが粉、栄養体に大麦由来の栄養体、菌糸活性剤にオルガK-1を用いました。これらを混合し、水を加え、含水率を65%程度に調整した後、菌床栽培用の袋に2.0kg詰めし、殺菌放冷後、あらかじめ培養した種菌の接種を行いました。
培養は、明環境下の培養室内で行い、光環境に差が生じるよう、棚の最上段、上から2段目、上から4段目に各4個供試体を設置しました(写真-3)。それぞれの棚の照度を測定したところ、最上段では約475lx、2段目では約100lx、4段目では約45lxでした。培養開始から60日後、発生室に移動させ、菌床袋の一部を切り取り、発生処理としました。その後、栽培室内で十分に成長した子実体を収穫し、生重量を測定しました。

写真-3.菌床ブロック供試体の培養状況
その結果、子実体発生量(平均子実体発生量±標準偏差)は、最上段705.5±189.7g、2段目594.5±121.2 g、4段目522.5±60.9gであり、本試験では光条件の違いによる収穫量に有意差は認められませんでした(Tukey-Kramer法、P > 0.05)。
今回紹介した試験では、供試体数が各4個と少なかったことから、現在供試体数を増やし、更なる検討を進めています。
◆おわりに
ハナビラタケの原基形成を誘導するためには、光が必要であること、また、光を照射する時期などにより、原基形成の反応が異なる可能性が示唆されました。
ハナビラタケの光による反応を詳細に明らかにすることで、培養・栽培方法の明確化だけではなく、光照射時間を最小限に抑えることによる節電効果など、低コスト化も期待できます。そのため、現在、培養中の光条件について、光量の調整を可能としたLEDなどを用い、より詳細な光環境に関する試験を行っています(写真-4、5)。今後も試験を重ね、適切な栽培条件を明らかにし、実際の生産現場で活用できるよう、栽培マニュアルなどを作成していきたいと考えております。

写真-4.LEDを用いた培養状況

写真-5.ハナビラタケの子実体発生状況